代谢改变是肿瘤细胞的关键标志之一。早在1956年,Otto Warburg 就观察到肿瘤细胞会优先利用糖酵解产生ATP而不是线粒体氧化磷酸化(OXPHOS)。值得注意的是,线粒体作为一种特殊的半自主性细胞器,拥有自己的DNA,还在细胞内承担着“能量工厂”的重要功能。

那么,线粒体与肿瘤的发生发展又会有怎样的联系呢?
近日,英国纽卡斯尔大学惠康基金会线粒体研究中心的研究人员在 Nature Cancer 杂志上发表题为:Age-associated mitochondrial DNA mutations cause metabolic remodeling that contributes to accelerated intestinal tumorigenesis 的研究论文。(– 2020/09/21 的论文)
这项研究表明,年龄相关的线粒体DNA突变使得线粒体氧化磷酸化(OXPHOS)功能发生缺陷,导致细胞代谢改变,进而加速肠道肿瘤的发生。

实际上,科学家们发现,在肿瘤细胞中,线粒体的OXPHOS功能在许多类型的肿瘤中均处于一种被下调的状态。与此同时,OXPHOS系统中的缺陷也是许多人类衰老组织中的一个共同特征。
在众多癌症类型中,结直肠癌会随着年龄的增长而愈渐高发,且与线粒体DNA(mtDNA)突变密切相关。因此,在这项研究中,Laura C. Greaves领导的研究团队探究了与年龄相关的mtDNA突变是否在结直肠癌的发生发展中起到重要作用。
为了验证这一点,研究人员构建了APC抑癌基因敲除的、OXPHOS系统缺陷的结直肠癌小鼠模型(Lgr5-creER;Apcfl/fl),并具有mtDNA突变。APC抑癌基因的敲除使得肿瘤细胞增殖速度加快且细胞凋亡减少,导致这些小鼠的肿瘤比对照组要大。

APC敲除、OXPHOS系统缺陷小鼠模型中肿瘤生长速度更快
紧接着,研究团队还发现,这些结直肠癌细胞可以通过上调丝氨酸的从头合成途径(SSP)进行代谢重塑从而应对OXPHOS系统缺陷。
与此同时,研究团队还在人类结直肠癌样本中进行了原位免疫组织化学(IHC)分析,他们发现在22个OXPHOS缺陷的肿瘤样本中,有18个具有一个或多个mtDNA突变。并且,他们还在正常老化的肠组织样本中观察到类似的mtDNA突变谱。

人类结直肠癌OXPHOS原位免疫组织化学分析
事实上,线粒体基因组有多个拷贝,但随着年龄的增长,不同的线粒体DNA(mtDNA)拷贝将累积越来越多的突变,直到相同体细胞mtDNA突变在单个细胞内累积到一个高水平状态,最终就可能导致OXPHOS系统缺陷。
论文第一作者 Anna Smith 表示,单个或少数几个线粒体DNA突变并不会有太大影响,但当这些突变积累到一定程度时,将会导致OXPHOS缺陷和代谢改变,从而在肿瘤发生过程中提供选择性代谢优势,此外,突变积累过程与年龄增长密不可分!
Anna Smith 还表示,他们的研究结果还引出了一个重要的问题——在遗传性致病mtDNA突变导致线粒体疾病的患者中,结直肠癌的发病率是否增加?
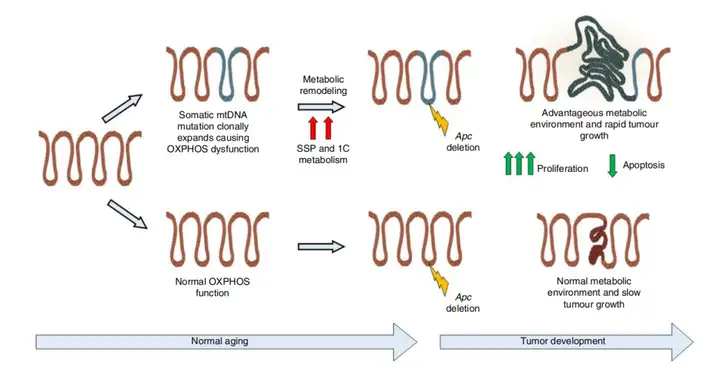
mtDNA突变和OXPHOS缺陷导致肿瘤发生的假设机制的示意图
总而言之,此项研究在小鼠模型和人类临床样本中证实,随年龄的增长,线粒体DNA(mtDNA)不断发生突变,导致线粒体的氧化磷酸化(OXPHOS)功能发生缺陷,从而改变了细胞的代谢方式,最终加速结直肠癌的发生发展。
更重要的是,这项研究还发现与年龄相关的线粒体OXPHOS缺陷可通过上调丝氨酸从头合成途径(SSP)促进肠癌细胞生长和存活,鉴于代谢途径是肿瘤治疗干预的重要靶点,未来可以开发针对SSP的靶向药物从而有效治疗结直肠癌等肠肿瘤。
论文链接:https://www.nature.com/articles/s43018-020-00112-5

![]()

