白藜芦醇是某些种子类植物 (spermatophytes), 在抵抗病原菌、损伤等侵袭时产生的植物抗毒素 (phytoalexin),广泛存在于葡萄科、百合科、豆科、 蓼科、伞形科等 70 多种植物中,其中包括藜芦、 虎仗和觉明等药用植物,以及花生、草莓及葡萄等 食物。白藜芦醇引起科学家的关注源于一项流行病 学调查中发现的“The French Paradox”现象,即法 国人虽然摄入高脂、高胆固醇饮食,但心血管疾病 发病率却很低,一般认为这与法国人经常饮用葡萄 酒有关 [1] 。随着对白藜芦醇研究的深入,发现此化 合物具有非常广泛的生物活性,如抗肿瘤、抗心血 管疾病、抗炎免疫、雌激素样活性和神经保护作 用等。
1 白藜芦醇及其衍生物与抗氧化活性
白藜芦醇及其衍生物是以均二苯代乙烯 (C6-C2-C6) 为基本骨架的酚类化合物。白藜芦醇的化 学名为 3,5,4′ -三羟基茋 (3,5,4′-trihydroxystilbene), 分子式 C14H12O3,相对分子质量 228.24,有反式 (trans-) 和顺式 (cis-) 两种构象 ( 图 1)。
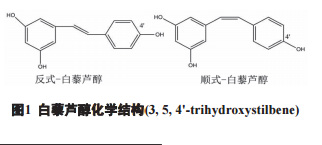
反式构象是其稳定结构,且反式异构体的生物 活性强于顺式,毒性也低于顺式,有较好的耐受性 和安全性,但在血浆中溶解度相对较低 [2-3]。
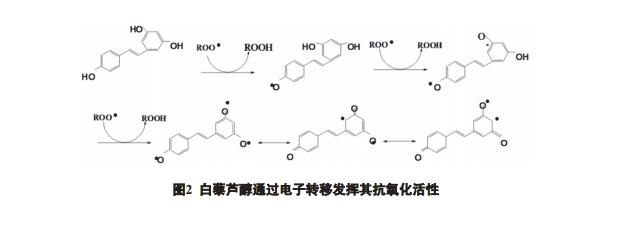
白藜 芦醇作为多酚类化合物,是很强的抗氧化剂,其酚 羟基是极好的氢或电子供体,形成的酚类游离基中 间体比较稳定,因其不存在适合于分子氧进攻的位 置,不会诱发产生新的游离基或者链反应 ( 图 2)。 通过对白藜芦醇及其类似物的氧化产物的分离鉴 定,已经确定白藜芦醇的抗氧化活性主要来自 4′- 羟基 [4]。
机体有多种抗氧化防御系统,抗氧化剂主 要是通过终止自由基链反应,清除自由基而保护机 体。此外,通过对白藜芦醇功能基团苯环进行结构 修饰,可获得具有较强抗氧化活性的诱导药,将苯 环上的羟基甲基醚化、糖苷化和形成二聚体后,能 在肿瘤、心血管疾病、神经退行性疾病中产生广泛 的药理效应 [5-8]。目前认为白藜芦醇及其衍生物的 心血管保护作用、神经保护作用等生物活性均与其 抗氧化活性相关。
除抗氧化活性外,近年来多项研究发现,白藜 芦醇可能以一种新的方式——调控非编码小 RNA 的表达而呈现多样的生物活性。人体中已鉴定出约 1 500 个 miRNA (20~22 nt)。成熟的 miRNA 与 RNA 诱导基因沉默复合物 (RNA-induce gene silencing complex, RISC) 相互作用,然后通过碱基互补与 靶信使 RNA (mRNA) 配对,切割 mRNA 或抑制其 转录,从而减低其编码蛋白的表达。miRNA 与肿瘤、 心血管疾病、神经退行性疾病、自身免疫性疾病等 密切相关 [9]。在 SW480 细胞系中首次发现白藜芦 醇对内源性 miRNA 具有调控作用,不仅能下调致 癌 miRNA (miR-17、21、23a、23b、25、29、146a、 miR-520h 等 ) 的表达水平,还能提高抑癌 miR-663 的表达水平。
近两年研究发现,白藜芦醇对 A549、 16HBE-T、CL1-5、PCa 前列腺瘤细胞中相应的 miRNA 也有调控作用,并且以剂量依赖性方式抑制 Akt,进而下调叉头框 c2 (forkhead box c2, FOXC2) 转录因子的表达,从而降低 A549、CL1-5 细胞的 转移和侵袭能力,这对于控制肿瘤的恶化具有重要 的临床意义 [10-14]。
另外,白藜芦醇还通过调控 miR- 133、miR-20b、miR-663、miR-30a,分别影响骨骼 肌细胞分化和转化、大鼠局部缺血 / 再灌注损伤模 型的心脏保护作用、炎症反应进程、自噬基因 Beclin 1 的调控 [15-18]。上述研究工作为白藜芦醇用 于治疗骨骼肌功能紊乱、炎症、肿瘤以及自身免疫 性等疾病提供了重要线索,但目前仍停留于动物实 验,缺乏相关的临床证据。
2 白藜芦醇在神经系统中的作用
近年来,白藜芦醇在神经系统中的作用也同样 引起广泛关注。白藜芦醇在多种体内外模型中具有 明显的神经保护作用,并证明有多种机制参与其中, 包括清除超氧羟自由基、脂氧自由基、超氧阴离子 自由基等抗氧化作用以及胞内信号转导途径[19-21]等。
2.1 白藜芦醇与脑缺血/缺氧
氧化应激损伤是脑缺血 / 再灌注损伤的重要原 因,并在脑缺血 / 再灌注损伤急性期各个环节中发 挥重要作用,而凋亡是脑缺血 / 再灌注损伤后神经 细胞死亡的重要形式 [22-23]。多项研究表明,白藜芦 醇能有效对抗因脑缺血 / 再灌注造成的神经损伤。 白藜芦醇预处理明显缩小脑梗死体积,可能机制与 基质金属蛋白激酶 9 (matrix metalloprotein kinase 9, MMP9) 的抑制有关 [24]。在缺血损伤后给予白藜芦 醇能有效减少梗死体积,并抑制缺血皮质中白细 胞介素 -1β (interleukin-2, IL-1β) 和肿瘤坏死因子 (tumor necrosis factor-α, TNF-α) 的表达和小神经胶 质细胞的激活以及活性氧簇 (reactive oxygen species, ROS) 的产生,提示其作用机制之一与抗炎性反应 有关 [25]。Bcl-2、Bax 和 Caspase-3 等凋亡相关蛋白 参与了脑缺血 / 再灌注损伤过程,在氧化性低密度
脂蛋白诱发的小鼠脑血管内皮细胞损伤模型中,白 藜芦醇能抑制凋亡前蛋白 Bax 从细胞质转至线粒 体膜,阻止凋亡因子 Cytc 从线粒体上释放,降低 Caspase-3 和 Caspase-9 的活性,表明白藜芦醇是通 过抗细胞凋亡而发挥神经保护作用 [26-27]。
在大鼠脑 局部缺血 / 再灌注损伤模型试验中,白藜芦醇能上 调与氧化应激相关的核因子 E2 相关因子 -2 (nuclear factor erythroid-2-related-factor 2, Nrf2) 和血红素加 氧酶 -1 (heme oxygenase, HO-1) 的表达,降低丙二 醛 (malondialdehyde, MDA) 水平,恢复超氧歧化酶 (superoxide dismutase, SOD) 活性,从而减少梗死 体积和大脑水容量,改善神经症状 [28]。
在小鼠永久 阻塞中脑动脉模型中进一步证实了上述结论,并发 现,如将小鼠的过氧化物酶体增殖物激活受体 α (peroxisome proliferator-activated receptor α, PPARα) 基因敲除,白藜芦醇则不能减小脑梗死灶的体积 [29]。 PPARs 是一类配体依赖的核激素受体,包括三个异 构体 PPARα、PPARβ 和 PPARγ。PPARs 在糖脂代谢、 细胞增殖和分化以及炎性反应中起不同作用,是重 要的药物作用靶点 [30-31]。PPARα 过度表达不利于局 部缺血 / 再灌注损伤后的心脏复苏,而低表达 PPARα 则能对抗局部缺血后损伤 [32]。因此,调节 PPARα 可能是白藜芦醇发挥神经保护作用的重要机 制之一。
2.2 白藜芦醇与脊髓急性及继发损伤
脊髓损伤和缺血是因外伤或外科手术造成截瘫 的常见原因,至今仍无有效的预防或治疗手段。鉴 于白藜芦醇对心脏、肾脏及脑等器官缺血损伤的保 护作用,人们期望白藜芦醇对脊髓损伤和缺血也有 保护作用。白藜芦醇对重物坠落 (weight-dropping) 诱发的大鼠脊髓损伤有保护作用,可显著改善神经 细胞超微结构的损伤,能对抗损伤造成的 MDA 水 平升高,还能通过提高 SOD 活性抑制炎性细胞因 子 IL-1β、IL-10、TNF-α、髓过氧化物酶(myeloperoxidase, MPO) 的表达,影响凋亡相关蛋白 (Bax、Bcl-2、 Caspase-3) 的表达,对抗脊髓损伤,提示其保护机 制可能是通过抗炎性和抗凋亡作用 [33-34]。在以兔为 对象的实验中也得到类似结果 :白藜芦醇能减轻因 血管阻塞导致脊髓缺血 / 再灌注而造成的损伤 ;生化 指标显示白藜芦醇可降低 MDA 水平,与大鼠实验结 果吻合,提示保护机制可能是通过抗氧化作用 [35]。
2.3 白藜芦醇与神经退行性疾病
阿尔茨海默病 (Alziheimer’s disease, AD) 是一 种中枢神经系统退行性疾病,其特征性病理改变为β 淀粉样蛋白 (amyloid β, Aβ) 沉积形成的细胞外老 年斑和 tau 蛋白过度磷酸化形成的神经细胞内神 经原纤维缠结,以及神经元丢失伴胶质细胞增生等。
多 项 流 行 病 学 调 查 显 示, 适 量 饮 用 红 葡 萄 酒 (300~400 mL/d) 可降低老年人阿尔茨海默病的发病 率 [36-39]。白藜芦醇可能通过清除 ROS 对抗 Aβ 诱导 的神经凋亡,或直接促进Aβ在神经元内的降解 [40-44]。
白藜芦醇对神经细胞线粒体也有作用,可通过抑制 复合物Ⅲ抑制线粒体呼吸链,从而促进ROS的清除, 抑制 ROS 的产生 [45]。在多巴胺能神经元毒素 1- 甲 基 1-4- 苯基吡啶处理的中脑切片,白藜芦醇能够抑 制多巴胺能神经元的丢失,并发现白藜芦醇呈浓度 依赖性抑制线粒体复合物Ⅳ和小胶质神经细胞的活 化,从而减少 ROS 的积累 [46]。这些实验结果印证 了流行病学的调查结果。 Sirtuins 是一类依赖辅酶Ⅰ的去乙酰化酶,在 基因沉默、DNA 修复和 rDNA 重组中起重要作用, 通过使转录因子 PGC1-α、PPAR γ 和核转录因子 κB (nuclear factor-kappaB, NF-κB) 脱乙酰化而调节其活 性,进而调控哺乳动物细胞寿命的多条信号通路, 并与细胞的存活和代谢过程以及增殖、衰老、凋亡 等生命活动密切相关 [47]。
白藜芦醇通过诱导 Sirt1 的表达,进而抑制 p53 和 FOXO 蛋白的活性以及阻 碍 NF-κB 信号转导,保护 AD 神经元免受 ROS、 过氧化氢、NO、Aβ 以及其他胞内胞外的损伤 [48-50]。 更值得注意的是,白藜芦醇和葡萄糖以及苹果酸盐 混合药 (NCT00678431) 正在进行Ⅲ期临床试验,有 望成为一种治疗轻度和中度 AD 的良药 [51]。
帕金森病 (Parkinson’s disease, PD) 是一种以黑 质、纹状体内多巴胺能神经元变性死亡为特征的神 经系统退行性疾病。大量研究表明,遗传、老化、 免疫异常、氧自由基损伤、钙超载、兴奋性神经毒 性等诸多因素与多巴胺神经元变性死亡有关,其中 氧化应激引起的细胞凋亡是多巴胺神经元减少的重 要环节 [52-53]。因此,改善黑质多巴胺能神经元的氧 化状态可能是防治帕金森病的重要方法之一。
白藜 芦醇在 PC12 细胞中可减轻 1- 甲基 -4- 苯基吡啶造 成的氧化损害,并能使表达降低的多巴胺转运体恢 复到正常水平,可能对帕金森病有治疗作用 [54]。褪 黑激素能增强白藜芦醇的抗氧化作用,通过抑制泛 素化依赖的蛋白酶体途径提高 HO-1 在初级神经元 和星形细胞中的表达水平,而 HO-1 具有组织特异 性的抗氧化效应 [55-56]。此外,口服白藜芦醇可显著 改善注射海人藻酸引起的大鼠嗅脑和海马中的谷氨酸脱羧酶水平下降,逆转脂质过氧化反应终产物 MDA 水平升高,并且呈浓度依赖性地抑制大鼠海 马神经元兴奋性突触传递和神经元自发放电,还明 显抑制 CA1 区椎体神经元海人藻酸诱导的电流, 对抗海人藻酸导致的海马区神经退行性变 [57-61],这 些为白藜芦醇保护神经细胞免受自由基氧化和兴奋 性毒性提供了依据。 亨廷顿病 (Huntington disease, HD) 是一种显性 家族遗传性疾病,由于基因突变或 CAG 三核苷酸 重复序列扩增引起异常蛋白积聚结块,从而导致神 经细胞退化,属于基因动态突变病或多谷氨酰胺重 复病,其发病机制可能是由于能量代谢异常引起氧 化损伤而导致神经细胞的兴奋毒性凋亡 [62] 。
白藜芦 醇由于其抗氧化活性而发挥抗神经凋亡作用。另外, 白藜芦醇可干扰细胞周期,使细胞停滞在 S 期,并 能调控线粒体介导的凋亡信号通路中凋亡相关蛋白 基因 (Bcl-2、Bcl-xL、Mcl-1) 的表达,影响神经细 胞的凋亡 [63] 。不仅如此,白藜芦醇能剂量依赖性地 激活神经细胞中的蛋白激酶 C (protein kinase C, PKC),其最大效应浓度和神经元保护浓度相近,表 明胞内信号转导通路参与白藜芦醇的抗神经细胞凋 亡作用 [20] 。白藜芦醇在抗 Aβ 毒性的同时可抑制酪 氨酸激酶及其下游激酶 ERK1/2 的活性,提示酪氨 酸激酶信号转导途径可能参与白藜芦醇的神经保护 作用 [19,64] 。
这些都表明,白藜芦醇通过多种机制展 示抗神经凋亡作用,从而在亨廷顿病中发挥保护神 经元的效应。 除抗神经凋亡作用外,白藜芦醇可通过激活主 要能量代谢感应器 / 效应器蛋白调控细胞进程,对 抗神经退行性疾病 [65-68] 。在哺乳动物神经细胞体外 实验中,白藜芦醇作为 Sirtuins 的激动剂,可对抗 突变的多聚谷氨酰胺所造成的蛋白质变性和细胞损 害、神经毒性,并使 Ku70 蛋白 ( 参与 DNA 损伤、 细胞存活 ) 去乙酰化,上述损害正与亨廷顿发病机 制假说相吻合 [69-71] ;但也有学者将 Sirt1 基因敲除, 发现白藜芦醇的活性被部分抑制,提示 Sirt1 过表 达可能对于白藜芦醇的活性很重要,白藜芦醇可能 协调调控多种途径发挥药理效应 [72-74] 。
2.4 白藜芦醇与癫痫和抑郁症
癫痫是一种由脑病变造成的脑细胞突然异常的 过度放电引发的脑功能失调疾病。癫痫发作时易引 起海马区齿状回神经元和椎体神经元退行性变化, 进而导致学习和记忆障碍,诱发持续性的认知功能 紊乱。除了控制神经元突发性异常放电,针对神经元的保护也可能是治疗癫痫的理想方法 [75-78] 。在探 讨白藜芦醇对大鼠海马神经兴奋性突触传递影响的 体外实验中,发现白藜芦醇可能通过多种机制发挥 神经保护作用 :
- (1) 抑制门控钾离子电流 ;
- (2) 抑制 海马 CA1 区神经元细胞电兴奋性 ;
- (3) 通过抑制突 触后谷氨酸受体阻碍兴奋性突触传递 [57,59,79] ,提示 白藜芦醇抗癫痫效应可能有抗氧化和抑制神经元兴 奋性等多种机制的参与。
另有研究显示 , 癫痫能激 活雷帕霉素哺乳动物靶点 (mammalian target of rapamycin, mTOR),提高 NF-κB 活性,促进炎症因子、 一氧化氮合酶 (nitricoxide synthase, NOS)、环氧合 酶 -2 (cyclooxygenase2, COX2)、IL-2 的表达。进一 步研究发现,白藜芦醇通过激活 mTOR 通路显著抑 制 NF-κB 的活性以及炎症分子的产生,同时也证实 了白藜芦醇对 mTOR 信号的抑制很大程度上是因为 腺苷酸活化蛋白激酶 (adenosine monophosphate activated kinase, AMPK) 的活化,提示了白藜芦醇可通 过激活 AMPK/mTOR 信号通路来抑制炎症反应, 从而发挥抗癫痫作用 [80] 。 抑郁症是一种以情感病态变化为主要症状的精 神病,其发病机制被认为与脑内单胺类神经递质失 调有关,特别是去甲肾上腺素 (norepinephrine, NE) 和 5- 羟色胺 (5-hydroxy tryptamine, 5-HT) [81-82] 。通 过胃管灌注食法给予抑郁模型小鼠白藜芦醇 (20、 40、80 mg/kg),观察到白藜芦醇对运动没有影响, 但能减少抑郁症小鼠的不稳定时间,并呈剂量依赖 性地激活单胺氧化酶 A (monoamine oxidase-A, MAO-A) 的活性,由此提出白藜芦醇的抗抑郁活性可能与 5-HT 和 NE 能活动有关。用白藜芦醇处理长期处于 压力状态下的大鼠,发现大鼠额皮质、海马区、下 丘脑区 5-HT 水平显著上升,额皮质、纹状体 NE 和多巴胺水平提高,抑制了大脑 4 区域,特别在额 皮质、海马区 MAO-A 的活性,而对 MAO-B 则没 有影响,表明白藜芦醇调节脑内单胺类递质的平衡 可能是其抗抑郁效应的主要机制之一 [83-84] 。
2.5 白藜芦醇的抗衰老效应
神经系统是白藜芦醇发挥抗衰老效应的重要作 用环节。衰老是一切生命由遗传因素和内外环境互 相作用下的生物过程,是机体功能退行性下降及紊 乱的综合变化。热量限制和 Sirtuins 活性增加能 延长有机体,如酵母、蠕虫、果蝇、哺乳动物的寿 命 [85-86] ,近年来有学者证实了白藜芦醇可部分模拟 热量限制的抗衰老效应。此外,发现白藜芦醇可竞 争性抑制 cAMP 磷酸二酯酶,激活 cAMP 效应蛋白,引起 Ca 2+ 内流增加进而激活 CamKKβ-AMPK 途径, 导致辅酶Ⅰ及 Sirt1 活性增加,进而改善年龄相关 代谢表型 [87] 。用白藜芦醇喂养鱼类后,对后天学习 能力有显著的维护作用,并可预防与年龄相关的脑 功能退行性疾病。
白藜芦醇干预可减少年龄依赖的 氧化生物标志物的堆积,进一步表明白藜芦醇具有 抗脑功能衰老的作用,但也不能排除白藜芦醇是通 过对神经系统的保护作用间接导致生物体寿命的 延长 [88-89] 。
更令人兴奋的是,白藜芦醇在体外对端 粒酶活性具有积极效应,这对于白藜芦醇抗衰老机 制的研究具有重要的指导意义,因为端粒酶功能障 碍与衰老密切相关,端粒缩短会促进细胞衰老或凋 亡。由于发现 Sirt1 参与端粒的修复,提示白藜芦 醇可能通过激活 Sirt1 来调节端粒酶活性 [90-93] 。这 些都为抗衰老药物的开发提供了重要的实验依据。
3 结语
综上所述,白藜芦醇在神经系统、心血管、 肿瘤等重要疾病中呈现出广泛的生物活性,因而 受到广泛重视。在多种神经系统疾病动物模型中, 白藜芦醇均显示较好的神经保护作用。虽然抗氧 化是白藜芦醇神经保护效应的主要机制,但也有 其他机制参与,包括抗炎、抗细胞凋亡以及对细 胞信号转导通路的调节等。因此,对白藜芦醇神 经保护作用的深入研究可能为预防和治疗神经系 统疾病提供方案。
然而,就白藜芦醇对神经系统 的作用而言,现有的研究结果还存在明显的不足 :
(1) 现有研究工作集中在形态学、生物化学和分子 生物学水平,缺乏白藜芦醇对于大脑的生理功能, 特别是在体神经电活动的实验证据 ;
(2) 虽已证明 包括抗氧化作用等多种机制参与白藜芦醇的神经 保护作用,但其相应的作用靶点和确切的作用机 制尚不明确 ;
(3) 虽然白藜芦醇在自然界广泛存在, 并作为食物被人类长期食用,支持其具有较低毒 性、耐受性和安全的特性,但更深入的毒性研究 对其作为治疗药物仍是必需的,如大剂量 (3 g/kg/d) 白藜芦醇可导致大鼠因肾毒性而死亡 [94] 。白藜芦 醇较低的生物利用度也可能是影响其应用的因素 之一 [95] ,但剂型改良可有效改善这个问题。最新 的一项研究报道,健康人每日服用 40 mg 改良剂 型的反式白藜芦醇,可有效提升血药浓度到 0.1~6 µM[96] 。因此,随着白藜芦醇对神经系统的整体影 响及分子机制的逐步阐明,其作为神经系统药物 应用的前景将更清晰。
摘自: http://www.lifescience.net.cn
![]()

