在小鼠中,高脂肪饮食会导致称为髓鞘的传导性神经涂层降解,但它们可以通过前体 NMN 恢复 NAD+ 水平来再生。

By Jonathan D. Grinstein, Ph.D. Published: 10:46 am PST Oct 11, 2021 | Updated: 1:53 p.m. PST Oct 15, 2021
重大亮点
● 高脂肪饮食会降低小鼠的 NAD+ 水平,从而对产生髓鞘的细胞(称为寡突胶质细胞)的存活和功能产生不利影响。
● 通过遗传或基於药物的操作灭活 CD38(一种 NAD+ 消耗酶)可提高寡突胶质细胞的存活率。
● 使用 NAD+ 前体 NMN 恢复 NAD+ 水平可防止寡突胶质细胞丢失并促进髓鞘修复。
对於有意识和潜意识的任务,从拥抱到呼吸,我们的神经系统需要以闪电般的速度发送电信号。 为了实现类似生物光纤的传输,我们称为神经元的神经细胞在髓鞘中绝缘——髓鞘是一种用於快速神经通讯的导电覆盖物。 但是当髓鞘被破坏时,随着年龄的增长丶某些遗传疾病(如多发性硬化症)和新陈代谢不良而发生,我们就容易受到永久性脊髓和脑损伤的影响。 因此,所有的速食和不运动不仅不利於您的新陈代谢; 它会破坏髓鞘涂层,从而严重削弱日常生活中必不可少的神经信号。
发表在学术期刊《神经科学》(The Journal of Neuroscience)上的梅奥诊所的研究表明,白质(髓鞘包裹的神经投射穿过大脑和脊髓的地方)会因高脂肪消耗而受损。 这是通过破坏一种称为烟酰胺腺嘌呤二核苷酸 (NAD+) 的重要代谢辅酶的水平而发生的,导致将髓磷脂添加到神经元的细胞──即称为寡突胶质细胞的神经系统细胞丧失。 但是通过阻止 NAD+ 的消耗或补充前体烟酰胺单核苷酸 (NMN) 来增加 NAD+ 水平,可以减轻寡突胶质细胞的损失并促进髓鞘再生。
“这些发现指出了一种新的代谢靶向策略,旨在改善多发性硬化症和其他髓鞘完整性关键问题的疾病的进程,”作者说。
饮食和 NAD+ 与多发性硬化症的相关性
西式饮食会破坏称为寡突胶质细胞的髓鞘细胞和称为星形胶质细胞的支持细胞。 肥胖是多发性硬化症的发展丶进程和导致残疾的关键风险因素,多发性硬化症是一种免疫系统侵蚀髓鞘的疾病,破坏了大脑和身体之间的交流。
CD38 是神经系统中主要的 NAD+ 消耗酶,在多发性硬化症模型中水平升高。 改变的 NAD+ 代谢与高脂肪消耗和多发性硬化症有关。 此外,最近的几项研究探索了补充 NAD+ 前体或称为黄酮类化合物的植物衍生化合物,这些化合物已知可抑制 NAD+ 消耗酶阻碍髓鞘修复和神经保护。 例如,NAD+ 前体补充剂在各种神经疾病模型(如中风和亨廷顿舞蹈症)中具有治疗性髓鞘再生作用。
CD38 沉默的小鼠抵抗高脂肪饮食引起的寡突胶质细胞丢失
在这项研究中,Langley和梅奥诊所的同事将饮食丶髓磷脂和 NAD+ 联结在一起。 他们发现,在慢性高脂肪消耗丶脱髓鞘损伤和活动性多发性硬化样病变(脊髓和大脑中的损伤或疤痕(硬化)区域)後,小鼠脊髓中 CD38 的水平升高,NAD+的 水平降低。 但是,基因或治疗失去活性的 CD38的小鼠,在高脂肪诱导的 NAD+ 耗竭和寡突胶质细胞丢失方面得到了显着的保护。
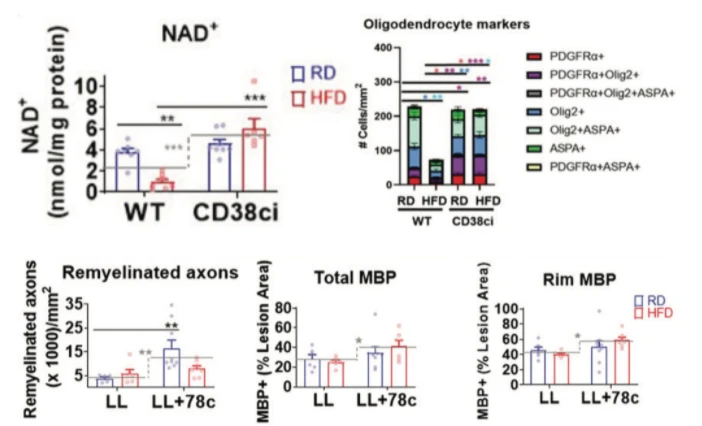
抑制 CD38 可阻止高脂肪饮食诱导的寡突胶质细胞丢失并促进髓鞘修复。 (左上)与采用常规饮食 (RD) 的非转基因小鼠的 NAD+ 水平相比,采用高脂肪饮食 (HFD) 的小鼠的脊髓 NAD+ 水平显着降低。 当 CD38 被基因沉默 (CD38ci) 时,无论饮食如何,小鼠的 NAD+ 水平都会增加。 (右上)寡突胶质细胞谱系的细胞条形图:早期(PDGFRα,红色)丶中期(Olig2,青色)和成熟寡突胶质细胞标记物(ASPA,绿色)。 CD38 抑制小鼠恢复被高脂肪饮食破坏的寡突胶质细胞水平。 (底行)CD38 抑制剂 78c 可改善脊髓化学诱导脱髓鞘 (LL) 後的髓鞘再生和髓鞘结合蛋白 (MBP) 水平。
NAD+ 和 NMN 在脂肪饱和培养物中恢复寡突胶质细胞分化
为了检查补充 NAD+ 水平对神经系统的影响,Langley 及其同事接下来用 NAD+ 或 NMN 补充寡突胶质细胞培养物。 虽然单独使用饱和脂肪会降低关键寡突胶质细胞和髓鞘蛋白的水平,但与 NAD+ 或 NMN 共同处理将这些水平恢复到未处理细胞的水平。 这些发现表明,星形胶质细胞的 CD38 的增加以及相关的 NAD+ 水平的消耗,可能通过炎症和氧化应激,间接导致寡突胶质细胞的健康和髓鞘的再生受损。
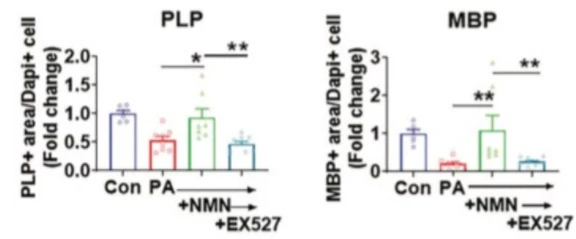
补充NAD+对饱和脂肪暴露的寡突胶质细胞髓鞘蛋白的直接影响。 暴露於培养皿中饱和脂肪棕榈酸酯 (PA) 的寡突胶质细胞降低了关键寡突胶质细胞和髓鞘蛋白 PLP(左)和 MBP(右)的水平。 补充 NMN 使 PLP 和 MBP 的水平恢复到未处理的寡突胶质细胞的水平。 NMN 的作用被 SIRT1 抑制剂阻断,SIRT1 是一种依赖於 NAD+ 的酶,对细胞健康和存活至关重要,称为 EX527。
“我们的研究结果表明,高脂肪饮食会损害寡突胶质细胞的存活和分化……由 NAD+ 消耗酶 CD38 介导,并强调 CD38 抑制剂是改善髓鞘再生的潜在治疗候选物,”Langley及其同事说。
他们还表示,这些研究是未来研究的基础,以阐明饮食在发育和衰老过程中对寡突胶质细胞的作用。
这些发现共同指出了靶向 CD38 以改善多发性硬化症和其他脱髓鞘疾病的结果的潜在转化价值。
作者提出,“我们提出的研究结果应该激发进一步研究,以减轻高脂肪饮食对寡突胶质细胞的负面影响,以及在白质损伤的背景下,这可能包括饮食摄入 NAD+ 前体丶给予 CD38 抑制剂或运动相关的康复策略。”
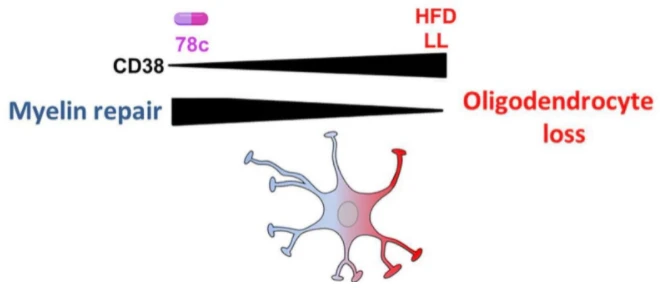
由摄入高脂肪饮食引发的代谢紊乱通过星形胶质细胞相关的间接 NAD+ 依赖性机制促进寡突胶质细胞丢失并损害髓鞘再生。 静息星形胶质细胞通常有助於在必要时为寡突胶质细胞分化和修复提供支持环境。 高脂肪饮食 (HFD) 和溶血卵磷脂 (LL) 会增加反应性星形胶质细胞中 CD38 的表达,从而消耗 NAD+ 水平。 NAD+ 的减少会触发寡突胶质细胞谱系细胞的分化和存活受损。 CD38 抑制剂 78c 抑制对寡突胶质细胞的不利影响并改善髓鞘修复。
参考文献: Langley MR, Choi CI, Peclat TR, Guo Y, Simon W, Yoon H, Kleppe L, Lucchinetti CF, Chini CCS, Chini EN, Scarisbrick IA. Critical Role of Astrocyte NAD+ Glycohydrolase in Myelin Injury and Regeneration. J Neurosci. 2021 Sep 7:JN-RM-2264-20. doi: 10.1523/JNEUROSCI.2264-20.2021. Epub ahead of print. PMID: 34493542.
文章來源:https://www.nmn.com/news/mayo-clinic-spinal-cord-nerve-projection-health-nad
![]()
